Il s’agit d’un exercice de calorimétrie typique, utilisant les méthode des mélanges, qui comprend :
- le calcul d’une température d’équilibre d’un mélange de deux phases condensées à des températures différentes ;
- la détermination de la valeur en eau (équivalent de la capacité thermique du calorimètre) du calorimètre ;
- la détermination de la capacité thermique massique d’un corps pur.
Énoncé de l’exercice
– Méthode des mélanges –
Un calorimètre contient $95{,}0~\mathrm{g}$ d’eau à $20{,}0^{\circ}\mathrm{C}$. On ajoute $70{,}0~\mathrm{g}$ d’eau à $50{,}0^{\circ}\mathrm{C}$.
1. Quelle serait la température d’équilibre si on pouvait négliger la capacité thermique du calorimètre et des accessoires ?
2. La température d’équilibre observée est de $31{,}3^{\circ}\mathrm{C}$. En déduire la valeur en eau du vase et des accessoires.
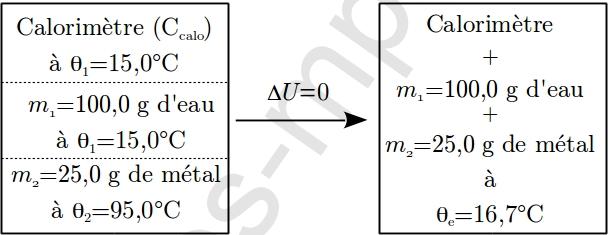
3. Le même calorimètre contient maintenant $100{,}0~\mathrm{g}$ d’eau à $15{,}0^{\circ}\mathrm{C}$. On y plonge un échantillon métallique pesant $25{,}0~\mathrm{g}$ sortant d’une étuve à $95{,}0^{\circ}\mathrm{C}$. La température d’équilibre étant $16{,}7^{\circ}\mathrm{C}$, calculer la capacité thermique massique du métal.
Corrigé de l’exercice
– Méthode des mélanges –

Si besoin, consultez les cours de BCPST1 de M Nicolas Clatin sur :
- Description d’un système thermodynamique
- Transfert d’énergie ; travail et chaleur
- Premier principe de la thermodynamique ; énergie interne et enthalpie